Hallo zusammne,
Mittwoch und Donnerstag kam ich zum Experimentieren, dabei habe ich einige an der Durchführung geändert, um der Anforderung des Experiment besser zu genügen.
Online Projektlabor Chemie
Technische Universität Berlin
Durchführung für die Spurenanalytik in Wasser
Leitung des Projektlabores: Prof. Dr. Th. Friedrich
Ersteller des Dokumentes: Daniel Christian Brüggemann
Studiengang: B.Sc. Chemie
Planung der Durchführung
Theorie
Atome sind in der Lage, Lichtquanten einer spezifischen Wellenlänge zu absorbieren. Daher ist
man mit einem Atomabsorptionsspektrometer in der Lage, nach dem selben Gesetzeslagen des Lambert-Beerschen Gesetzes zu arbeiten, wodurch eine genaue Bestimmung einer Probe mit Metallionen möglich ist.
Dazu ist eine Hohlkathodenlampe nötig, die die Wellenlänge des zu untersuchenden Stoffes entspricht. Dadurch lassen sich Metalle und Halbmetalle sehr genau untersuchen. In der
Untersuchung wird der zu untersuchende Stoff in einer Kammer verdunstet und in eine
Acetylen/Luft Flamme geleitet, die ausreichend Energie liefert für die Atomisierung der Stoffe jedoch mit ca. 2300 °C auch nicht zu heiß ist, die Probe zu oxidieren. Dies basiert auf dem theoretischen Grundlagen von Herrn Bunsen, der festgestellt hat, dass Atome bei einer genügenden Anregung Licht emittieren.
Diese Methode wird heute immer noch bei der Flammprobe genutzt.
Geräte und Chemikalien
Kupfersulfat Pentahydrat alternativ Kupfer(II)-nitrat, Eisen-(II)-Sulfat-Heptahydrat, Zinksulfat Heptahydrat, Flammrohr-AAS, 25x100 ml Messkolben, Mineralwasser
Durchführung
Es wird ein Kupferrohr, ein Stahlrohr und ein verzinktes Stahlrohr mit Mineralwasser befühlt und 24 h stehen gelassen. Wenn die technische Möglichkeit besteht, wird dies für Mischrohrverbindung durchgeführt, die in den Kombinationen Stahlrohr-Kupferrohr (P2), und Mehrschichtverbundrohr-Kupferrohr (P3) durchgeführt werden.
Die Wasserproben werden in 100 ml Messkolben überführt.
Sollte eine der Probe eine höhere Konzentration, als der unten aufgeführte Kalibrationsbereich für die einzelnen Elemente vorsieht, werden diese F100 verdünnt.
Dazu werden 1 ml der Probe in ein 100 ml Messkolben gegeben und auf 100 ml aufgefüllt. Es ist beim Berechnen der Gehaltskonzentration der Probe zu beachten, dass der Gehalt dann mit 100 multipliziert werden muss, um den Gehalt ohne Verdünnung zu erhalten.
Die daraus resultierenden Proben werden anschließend im AAS vermessen und der Gehalt über die folgende Kalibration bestimmt.
Da Mineralwasser als Probenmatrix verwendet wird, kann damit gerechnet werden, dass unterschiedliche pH-Werte vorhanden sind, daher werden von diesen vorher der pH-Wert gemessen, um eventuelle pH-Wert Abhängigkeiten zu untersuchen.
Gemäß der „Verordnung über die Qualität von Wasser für den menschlichen Gebrauch“ (Trinkwasserverordnung – TrinkwV 2001) sind folgende Grenzwerte gesetzlich festgelegt.
Kupfer ist gemäß §6 Abs. 2 TrinkwV in Anlage II Teil II geregelt, dabei ist Kupfer mit 2,0 mg/L in Bereich der chemischen Anforderungen reguliert und beschränkt.
Eisen ist in Bereich der allgemeinen Indikatorparameter gemäß §7 TrinkwV Anlage III geregelt mit 0,2 mg/L.
Zink wird in dieser Verordnung nicht mehr genannt. Zitat: „Die TrinkwV 2001 enthält keine Angaben zu Zink. In der TrinkwV von 1990 ist für den Gehalt an Zink in Trinkwasser ein Richtwert (kein Grenzwert) von 5 mg/L angegeben.“
(Zitiert von: http://www.ifau.org/trinkwasser/smetalltwinfo-uebersicht.htm, Abrufdatum: 17.9.2014)
Diese Werte sind für die Kalibration zu beachten.
Herstellung der Kalibrationslösungen
Zur Vermessung der Proben auf ihren Kupfergehalt, werden 0,1 L Kupferstammlösung (β=1 g/L) hergestellt.
Dazu wird eine Kupfersulfat-Lösung genutzt, dabei wird folgende Einwaage vorgenommen:
Es muss daher 392,93 mg an Kupfersulfat eingewogen werden. Diese Stammlösung wird F10 verdünnt, es werden also 10 ml abgenommen und auf 100 ml aufgefüllt.
Diese neue Stammlösung hat folglich die Konzentration von 0,1 g/L = 100 mg/l. Auf dieselbe Konzentration werden auch die anderen Schwermetalllösungen gebracht
Kalibration der Kupferstammlösung
Daraus werden fünf Kalibrierlösungen für Kupfer hergestellt zwischen 0,1 mg/L und 4 mg/l hergestellt, dazu wird folgende Gleichung verwendet:
Damit benötigen wir 1 ml der verdünnten Stammlösung auf 100 ml für die erste Kalibrierlösung.
Für die anderen Lösungen ergeben sich damit folgende Volumen:
| Index: | Volumen F10 in ml | Konzentration in mg/L |
| 1 | 0,05 | 0,1 |
| 2 | 0,5 | 1 |
| 3 | 1 | 2 |
| 4 | 1,5 | 3 |
| 5 | 2 | 4 |
In Falle des nutzen von Kupfer(II)-nitrat ändern sich die Einwaage wie folgt:
Tabelle 3: Einwaage bei der Verwendung von Kupfer(II)-nitrat
In den Fall werden dann 295,14mg an Kupfer(II)-nitrat benötigt. An der Kalibration jedoch ändern sich nichts und es kann mit den Werten von oben gearbeitet werden.
Einwaage für die 1 g/L Zink-Stammlösung und Kalibration der Zinkstammlösung
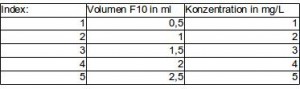
In den Fall werden dann 436,78 mg an Zinksulfat Pentahydrat benötigt. Um in Einklang mit den oberen Richtwert zu sein, wird die Kalibration von 1 mg/L bis 5 mg/L in 50 ml Messkolben durchgeführt. Die Kalibration ist wie folgt:
Einwaage der 1 g/L Eisenstammlösung und dessen Kalibration
In den Fall werden dann 497,81mg an Eisen(II)-Sulfat Pentahydrat benötigt. Um in Einklang mit den oberen Grenzwerten zu sein, wird die Kalibration von 0,025 mg/L und 0,4 mg/L in 50ml Messkolben durchgeführt. Die Kalibration ist wie folgt:
Quellen:
Für diese Arbeit wurde sich auf folgende Quellen bezogen:
- Trinkwasserverordnung in der Fassung der Bekanntmachung vom 2. August 2013 (BGBl. I S. 2977), die durch Artikel 4 Absatz 22 des Gesetzes vom 7. August 2013 (BGBl. I S. 3154) geändert worden ist
- Institut für Angewandte Umweltforschung e.V., „Schwermetalle im Trinkwasser“ Abgerufen von: http://www.ifau.org/trinkwasser/smetalltwinfo-uebersicht.htm, Abrufdatum: 17.9.2014
 OPLC_Praktische_Durchfuerhung (130,9 KiB, 1.383 hits)
OPLC_Praktische_Durchfuerhung (130,9 KiB, 1.383 hits)